Modelo
Atómico
El modelo atómico es una representación
molecular de un átomo, que trata de explicar su cambio de propiedades. De
ninguna manera debe ser interpretado como un diagrama de un átomo, sino más
bien como el diagrama conceptual de su funcionamiento. A lo largo del tiempo
existieron varios modelos atómicos y algunos más elaborados y complejos que
otros:
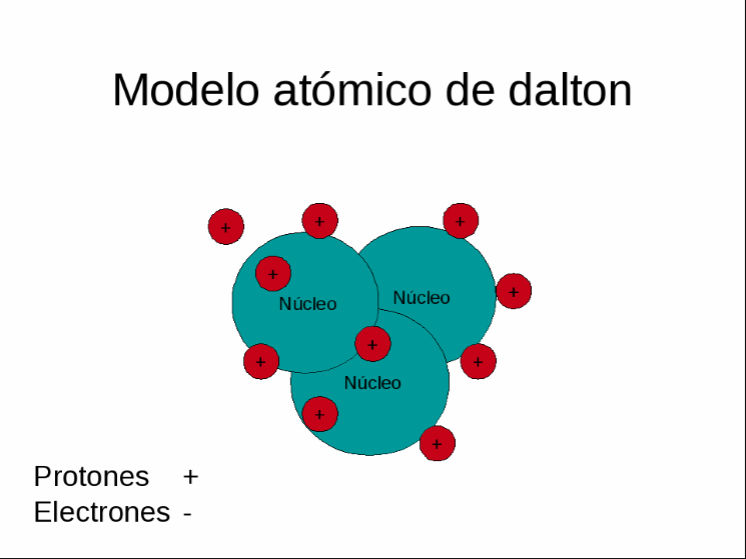
Modelo
atómico de John Dalton
Este fue formulado en el año 1808, Dalton
consideraba a los átomos indivisibles e indestructibles. Pensaba que los átomos
de un mismo elemento son iguales entre si teniendo cualidades y peso propio
diferentes al de otros elementos pueden combinarse entre sí y formar
diversos compuestos. Dalton describió a
los átomos como minúsculas partículas con forma esférica inmutables e
indivisibles.
Modelo
atómico de Thomson
En el año 1898 Joseph J.
Thomson propuso en 1898 uno de los primeros modelos atómicos. Describió el
átomo como una esfera con carga positiva en la que estaban
"incrustadas" unas pocas partículas con carga negativa llamadas
electrones.
Modelo
atómico de Rutherford
En 1911 los experimentos realizados por el
físico británico Ernest Rutherford le llevaron a deducir que la carga positiva
de un átomo y la mayoría de su masa están concentradas en una pequeña región central
llamada núcleo. En el modelo de Rutherford, los electrones, cargados
negativamente, giraban alrededor del núcleo como los planetas en torno al Sol.
Modelo
atómico de Bohr
En el año 1913, el físico danés Niels
Bohr descubrió que los electrones de un átomo sólo pueden tener determinados
valores de energía. Propuso que la energía de un electrón estaba relacionada
con la distancia de su órbita al núcleo. Por tanto, los electrones sólo giraban
en torno al núcleo a determinadas distancias, en "órbitas
cuantizadas", que correspondían a las energías permitidas.
Modelo
atómico de Schrödinger
En 1926, el físico austriaco Erwin
Schrödinger introdujo un cambio revolucionario en el modelo atómico. Según el
modelo propuesto, los electrones no giran en torno al núcleo, sino que se
comportan más bien como ondas que se desplazan alrededor del núcleo a
determinadas distancias y con determinadas energías. Este modelo resultó ser el
más exacto: los físicos ya no intentan determinar la trayectoria y posición de
un electrón en el átomo, sino que emplean ecuaciones que describen la onda
electrónica para hallar la región del espacio en la que resulta más probable
que se encuentre el electrón.
Este
modelo nos ha ayudado a comprender mejor la teoría atómica y a darnos una idea
de cómo está conformada la materia, con esto logramos reconocer los diferentes
avances y las modificaciones que el modelo atómico ha sufrido a lo largo de los
años.




No hay comentarios.:
Publicar un comentario